新冠疫情的出现,各行各业都受到影响,临床试验更甚,由于很多工作要到医院进行,所以“逼迫”从业者们静静思考沉淀,有哪些事情在平常繁忙的工作中可能被忽略?哪些工作是可以不受“无法去医院”的影响而完成的?
于是,一个很早就提出过的概念:“基于风险的监查RBM”,最近又频繁出现在行业中,最吸引人的一点就是RBM提供了除“现场监查”以外的监查方法,简言之,不用去医院(中心、机构)也可以达到项目监查的目的。
此篇文章将从三方面进行RBM的首次讲解。
2013
FDA正式颁布了临床试验新的监查指导原则《赌球平台推荐》。
该原则强调了中心化监查(centrlized monitoring)的重要性,提出了申办者可根据试验设计,采用不同类型相结合的监查模式,提高效率节约资源。
2016
ICH国际人用药品注册技术协调会于2016年11月发布了新版GCP指导原则ICH E6(R2)。
鼓励申办者建立系统优化的基于风险的方法来监查临床试验,可选择现场监查与中心化监查相结合或有充分理由只做中心化监查,提高临床研究的效率。该指导原则还给出了中心化监查的定义和方法。
2016
中国国家食品药品监督管理总局(CFDA)于2016年发布的《赌球平台推荐》(征求意见稿)中提到“申办者应当建立系统的、有优先顺序的、基于风险评估的方法,对临床试验实施监查。”
有了官方“撑腰”,做起事来也名正言顺。那么RBM的优势主要体现在哪些方面呢?
根据指标优胜联席会(Metrics Champion Consortium,MCC)的调查结果,RBM的三个优势是降低监查成本、提高数据质量、改善质量监督。
如果把RBM的精髓用一句话总结,可以说:RBM实现了监查模式的转变,由传统的“发现问题-解决问题”转变为“识别风险-预防问题”,这样避免了后续的问题产生,并节约了解决问题产生的成本。那么关键就在于如何“识别风险”。
下面这张图展示了一个RBM实施的流程:
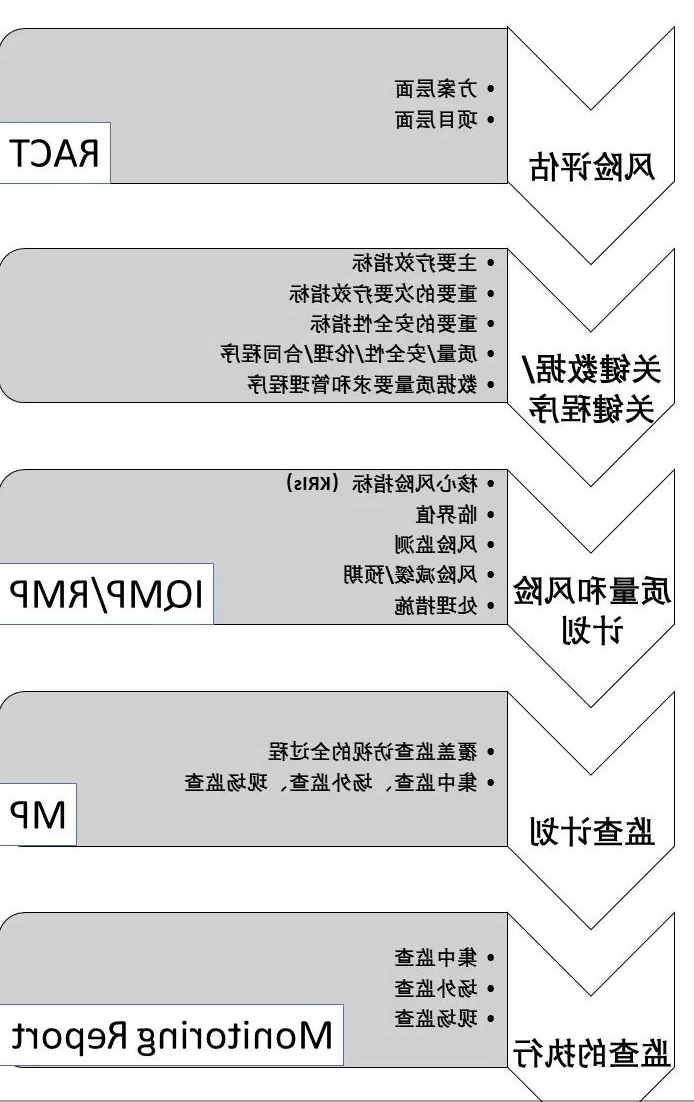
简而言之,分两步
第一步:进行风险评估,识别需要监查的关键数据和程序,也就是“把时间和精力,放在最重要的事情上”。
那么看起来第一步是比较玄妙的,如何对项目进行风险评估?有没有先例可以借鉴?别说,还真有,行业中早有组织机构群策群力,琢磨出各种“风险评估的工具”,让我们能快速实施风险评估。
其中行业内用得最多的是一个名为RACT(Rist Assessment and Categorization Tool)的风险评估模板。它一个非营利性组织TransCelerate开发,它由FDA,EU和药厂支持,在临床试验和药物研发上进行一些项目合作和知识共享,网址是transceleratebiopharmainc.com,该模板可在该网站上免费下载。
RACT从形式来说是一个带有公式的excel表格,里面从整个试验各个角度将可能的风险进行分类并评分,随意列出几个,比如“项目团队的经验”“药物供应链的情况”“获取数据的工具,纸质还是电子”等等,最后还会给出一个综合的风险评分,给如何提高项目质量,预防问题产生提供参考。
用文字叙述有些抽象,大家感兴趣的话还是自己去网站上下载来自己看一看,大概会兴奋于该工具提供的新思路。
第二步:根据风险评估结果,制定相应监查计划,什么时候必须去现场监查,什么时候采取中心化监查和场外监查,分析可能产生的问题和预先提供解决方法。
